Team:Paris Saclay/Notebook/July/25
From 2013.igem.org
(Difference between revisions)
(→2 - Electrophoresis to check the colony PCR of NarK, NarG, NirB) |
(→2 - Electrophoresis to check the gel purification of Term) |
||
| Line 20: | Line 20: | ||
{| | {| | ||
| - | | style="width:350px;border:1px solid black;" |[[]] | + | | style="width:350px;border:1px solid black;" |[[File:Psgel2507.jpg]] |
| style="width:350px;border:1px solid black;vertical-align:top;" | | | style="width:350px;border:1px solid black;vertical-align:top;" | | ||
* Well 1 : 6µL of DNA 6X loading dye | * Well 1 : 6µL of DNA 6X loading dye | ||
| Line 26: | Line 26: | ||
* Gel : 1% | * Gel : 1% | ||
|} | |} | ||
| - | |||
| - | |||
| - | |||
{| | {| | ||
Latest revision as of 00:23, 5 October 2013
Notebook : July 25
Lab work
A - Aerobic/Anaerobic regulation system
Objective : obtaining BBa_K1155003, BBa_K1155007
1 - Gel purification of Term
Xavier, Zhou
Protocol : [http://www.mn-net.com/tabid/1452/default.aspx Gel purification ]
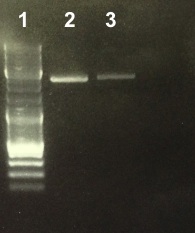
2 - Electrophoresis to check the gel purification of Term
Abdou, Anaïs
|
|
|
The gel purification was good. We will ligate it. |
3 - PCR of BBa_K592209 with RBS-Amil CP primer and suffix : pSB1C3
Xavier
We have designed our RBS primer thanks to BBa_B0034.
Used quantities :
- Buffer phusion : 10µL
- dNTP : 1µL
- Oligo RBS-Amil CP : 2µL
- Oligo suffix pSB1C3 : 2µL
- DNA : 2µL
- Phusion : 0.25µL
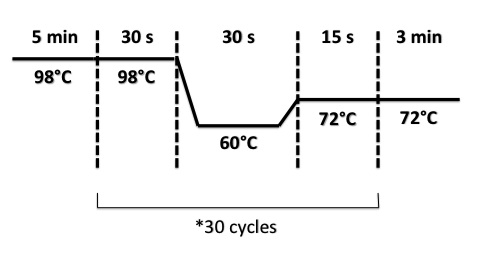
PCR program :
4 - Digestion of Colony PCR products : RBS-Amil CP by EcoRI/SpeI
Anaïs
Used quantities :
- RBS-Amil CP : 10µL
- Buffer FD : 3µL
- EcoRI FD : 1.5µL
- SpeI FD : 1.5µL
- H2O : 14µL
We let the digestion 1h30 at 37°C.
Objective : obtaining BBa_K1155004, BBa_K1155005, BBa_K1155006
1 - PCR of NarK, NarG, NirB
Abdou, Xavier, Zhou
Used quantities :
- NarK :
- Buffer phusion : 10µL
- dNTP : 1µL
- Oligo 47 : 2µL
- Oligo 48 : 2µL
- DNA : 2µL
- Phusion : 0.25µL
- NarG :
- Buffer phusion : 10µL
- dNTP : 1µL
- Oligo 49 : 2µL
- Oligo 50 : 2µL
- DNA : 2µL
- Phusion : 0.25µL
- NirB :
- Buffer phusion : 10µL
- dNTP : 1µL
- Oligo 45 : 2µL
- Oligo 46 : 2µL
- DNA : 2µL
- Phusion : 0.25µL
PCR Program :
2 - Electrophoresis to check the colony PCR of NarK, NarG, NirB
Zhou

|
|
Expected sizes :
- NarK : 500bp
- NarG : 500bp
- NirB : 500bp
|
We can't see anything. We lost our Colony PCR products. We will do the Colony PCR again. |
3 - Colony PCR of NarK, NarG, NirB
Abdou, Xavier
Used quantities :
- NarK :
- Buffer phusion : 10µL
- dNTP : 1µL
- Oligo 47 : 2µL
- Oligo 48 : 2µL
- DNA : 2µL
- Phusion : 0.25µL
- NarG :
- Buffer phusion : 10µL
- dNTP : 1µL
- Oligo 49 : 2µL
- Oligo 50 : 2µL
- DNA : 2µL
- Phusion : 0.25µL
- NirB :
- Buffer phusion : 10µL
- dNTP : 1µL
- Oligo 45 : 2µL
- Oligo 46 : 2µL
- DNA : 2µL
- Phusion : 0.25µL
PCR Program :
B - PCB sensor system
Objective : obtaining BBa_K1155002
1 - Ligation of BphA1 in pSB1C3
Anaïs, Zhou
Used quantities :
- BphA1 : 2µL
- pSB1C3 : 3µL
- Buffer ligase : 1µL
- Ligase : 1µL
- H2O : 3µL
| Previous day | Back to calendar | Next day |
 "
"