Team:Paris Saclay/Notebook/July/30
From 2013.igem.org
Notebook : July 30
Lab work
A - Aerobic/Anaerobic regulation system
Objective : obtaining BBa_K1155004, BBa_K1155005, BBa_K1155006
1 - Inactivation of EcoRI/SpeI used of the digestion of PCR products : NarK, NarG, NirB
Xavier
Protocol : Ethanol precipitation
We used 30µL of DNA.
Objective : obtaining BBa_K1155003, BBa_K1155007
1 - Tranformation of BBa_K1155003 in DH5α
Abdou
Protocol : Bacterial transformation
2 - Digestion of BBa_I732017 by EcoRI/PstI
Zhou
Used quantities :
- BBa_I732017 : 10µL
- Buffer FD : 3µL
- PstI FD : 1.5µL
- EcoRI FD : 1.5µL
- H2O : 14µL
We let the digestion 1h30 at 37°C.
3 - Electrophoresis to check the digestion of BBa_I732017 by EcoRI/PstI
Zhou
| [[]] |
|
Expected size :
- RBS-LacZ : 3093bp
|
We obtain fragments at the right size. We will purify it. |
4 - Gel purification of digestion of BBa_I732017 by EcoRI/PstI
Xavier
Protocol : Gel purification
|
We used wrong enzymes. We will do it again with EcoRI/SpeI. |
5 - Digestion of BBa_I732017 by EcoRI/PstI
Abdou
Used quantities :
- BBa_I732017 : 10µL
- Buffer FD : 2µL
- SpeI FD : 1µL
- EcoRI FD : 1µL
- H2O : 6µL
We let the digestion 1h30 at 37°C.
6 - Electrophoresis to check the digestion of BBa_I732017 by EcoRI/SpeI
Zhou
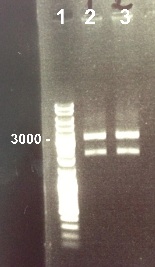
|
|
Expected size :
- RBS-LacZ :
|
We obtain fragments at the right size. We will purify it. |
7 - Gel purification of digestion of BBa_I732017 by EcoRI/PstI
Xavier
Protocol : Gel purification
|
We lost our fragments. We will do the digestion again. |
A - Aerobic/Anaerobic regulation system / B - PCB sensor system
Objective : obtaining FNR and BphR2 proteins
1 - PCR of : BphR2 Part I, BphR2 Part II, RBS-BphR2 Part I, FNR Part I, FNR Part II, RBS-FNR Part I
Abdou, Xavier
Used quantities :
- Bphr2 Part I :
- Oligo 54F : 4µL
- Oligo 55R : 4µL
- Buffer Dream Taq : 40µL
- DNA of Pseudomonas pseudoalcaligenes : 2µL
- dNTP : 4µL
- Dream Taq : 1µL
- H2O : 146µL
- Bphr2 Part II :
- Oligo 56F : 4µL
- Oligo 57R : 4µL
- Buffer Dream Taq : 40µL
- DNA Pseudomonas pseudoalcaligenes : 2µL
- dNTP : 4µL
- Dream Taq : 1µL
- H2O : 146µL
- RBS-Bphr2 Part I :
- Oligo 58F : 4µL
- Oligo 57R : 4µL
- Buffer Dream Taq : 40µL
- DNA Pseudomonas pseudoalcaligenes : 2µL
- dNTP : 4µL
- Dream Taq : 1µL
- H2O : 146µL
- FNR Part I :
- Oligo 59F : 4µL
- Oligo 60R : 4µL
- Buffer Dream Taq : 40µL
- DNA Escherichia coli : 2µL
- dNTP : 4µL
- Dream taq : 1µL
- H2O : 146µL
- FNR Part II :
- Oligo 61F : 4µL
- Oligo 62R : 4µL
- Buffer Dream Taq : 40µL
- DNA Escherichia coli : 2µL
- dNTP : 4µL
- Dream Taq : 1µL
- H2O : 146µL
- RBS-FNR Part I :
- Oligo 63F : 4µL
- Oligo 62R : 4µL
- Buffer Dream Taq : 40µL
- DNA Escherichia coli : 2µL
- dNTP : 4µL
- Dream Taq : 1µL
- H2O : 146µL
- PSB1C3 :
- Prefixe 51 : 4µL
- Suffixe 52 : 4µL
- Buffer Dream Taq : 40µL
- DNA : 2µL
- dNTP : 4µL
- Dream Taq : 1µL
- H2O : 146µL
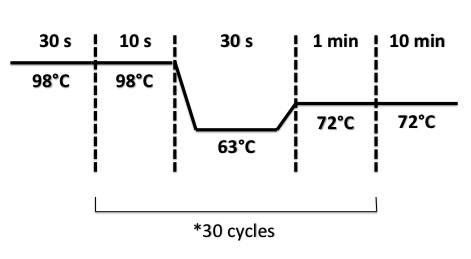
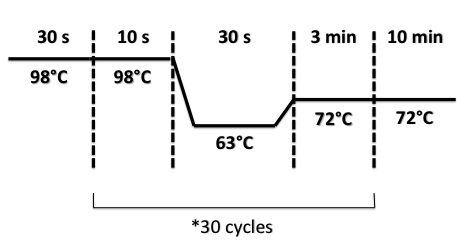
PCR Program :
- BphR2 Part I, BphR2 Part II, RBS-BphR2 Part I :
- FNR Part I, FNR Part II, RBS-FNR Part I :
2 - Electrophoresis of the PCR products : BphR2 Part I, BphR2 Part II, RBS-BphR2 Part I, FNR Part I, FNR Part II, RBS-FNR Part I
Expected size
- BphR2 Part I : 178 kb
- BphR2 Part II : 790 kb
- RBS-BphR2 Part I : 197 kb
- FNR Part I : 597 kb
- FNR Part II : 200 kb
- RBS-FNR Part I : 615 kb
- PSB1C3 : 2070bp
|
We can't see RBS-BphR2 Part I fragments at the good size. We will make the PCR again with a new PCR Program. We obtain BphR2 Part I, BphR2 Part II, FNR Part I, Fnr Part II and RBS-FNR Part I frangments at the right size thanks to the PCR. We will purify it. |
3 - PCR of : RBS-BphR2 Part I
Abdou, Xavier
Used quantities :
- Oligo 54F : 4µL
- Oligo 55R : 4µL
- Buffer Dream Taq : 40µL
- DNA : 2µL
- dNTP : 4µL
- Dream Taq : 1µL
- H2O : 146µL
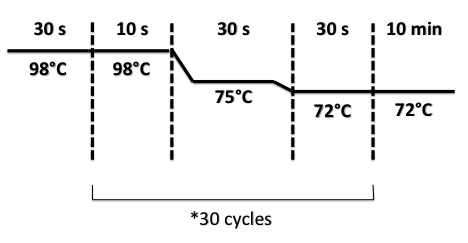
PCR Program :
4 - Gel purification of PCR of : RBS-BphR2 Part I
Xavier
Protocol : Gel purification
|
We lost our fragments. We will do the PCR again. |
B - PCB sensor system
Objective : obtaining Bba_K1155002
1 - Colony PCR of Bba_K1155002 in DH5α
Abdou, Xavier
|
The transformation was good. We will make a Colony PCR. |
We used 25 different colonies.
Used quantities :
- Oligo 43F : 0.5µL
- Oligo 44R : 0.5µL
- Buffer Dream Taq : 35µL
- DNA : 2µL
- dNTP : 0.5µL
- Dream Taq : 0.25µL
- H2O : 25µL
2 - Electrophoresis of the Colony PCR of Bba_K1155002 in DH5α
Abdou, Xavier
| File:Ps.jpg|350px]] |
|
Expected sizes :
- Bba_K1155002 : 169bp
|
We obtain fragments at the right size. We will sequence it. |
| Previous day | Back to calendar | Next day |
 "
"