Team:Paris Saclay/Notebook/August/13
From 2013.igem.org
Contents |
Notebook : August 13
Lab work
A - Aerobic/Anaerobic regulation system
Objective : obtaining ...
1 - Electrophoresis of digestion of Bba_K1155000 by SpeI and PstI
Nadia
| [[]] |
|
Expected sizes :
- Pfnr : ...
- PSB1C3 : ...
|
We can't see any band for Bba_K1155000 digestion. The digestion failed because we have used wrong enzymes. We will do it again with the good ones. |
2 - Digestion of Bba_K1155000, Bba_K1155004, Bba_K1155005, Bba_K1155006 by SpeI and by SpeI/EcoRI
Anaïs, Nadia
- Bba_K1155000 :
- Buffer : 5µL
- H2O : 39µL
- DNA : 5µL
- SpeI : 1µL
- Bba_K1155000 :
- Buffer : 5µL
- H2O : 38µL
- DNA : 5µL
- SpeI : 1µL
- EcoRI : 1µL
- Bba_K1155004, Bba_K1155005, bba_K1155006 :
- Buffer : 2µL
- H2O : 7µL
- DNA : 10µL
- SpeI : 1µL
- Bba_K1155004, Bba_K1155005, bba_K1155006 :
- Buffer : 2µL
- H2O : 6µL
- DNA : 10µL
- SpeI : 1µL
- EcoRI : 1µL
Obtaining RBS_LacZ+Term_PSB1C3
1 - Colony PCR on e.coli with RBS_LacZ+Term_PSB1C3 for 25 colonies
Anaïs
- Colony counting :
- Low concentration petri dish : 47 colonies
- High concentration petri dish : 145 colonies
- Picking of 25 colonies
- Preparation of 700µL of Master mix
- H2O : 590µL
- dNTP : 28µL
- VF2 primer : 3.5µL
- VR primer : 3.5µL
- DreamTaq buffer 10x : 70µL
- DreamTaq enzyme : 5µL
Protocol : Colony PCR
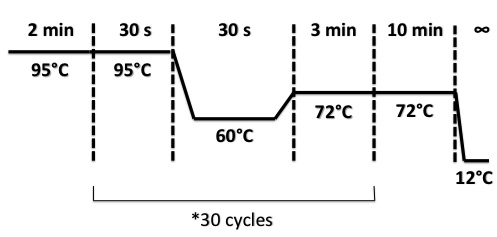
PCR Program :
2 - Gel electrophoresis of the colony PCR products
Anaïs, Damir

|
|
Expected size : 3583bp
Colonies 10, 14, 15 exhibit plasmids with the right length.
3 - PCR product (made the 08/01/2013) purification
Damir
available quantity:
- FNR Part1 : 10 µl
- FNR Part2 : 19 µl
- RBS FNR Part1 :16.1µl
- RBS BphR2 Part1 : 28µl
- BphR2 Part1 : 16.4 µl
- BphR2 Part2 : 18.9 µl
Protocol : kit purification
Manipulation error : The elution step was made using the recuperation tube from the filtering step, instead of a new, clean eppendorf tube.
 "
"