Team:Paris Saclay/Notebook/July/15
From 2013.igem.org
Contents |
Notebook : July 15
Lab work
A - Aerobic/Anaerobic regulation system
Objective : obtaining Bba_K1155000
1 - Sequensis analysis of Bba_K1155000
Abdou
WE OUR FIRST BIOBRICK ! The sequence analysis was good. We call our biobrick Bba_K1155000.
Objective : obtaining Bba_K1155003, bba_K1155007
1 - Liquid culture of Bba_B0010, Bba_B0015, Bba_B0017, Bba_I732019
Sheng, Zhou
|
Tranformations of 07/12/13 works. We will do a liquid culture of them. |
We used 5 colonies of each plasmid.
2 - Digestion of Bba_B0010 by EcoRI/PstI
Anaïs
Used quantities :
- DNA : 20µL
- Buffer FD : 3µL
- EcoRI : 1µL
- PstI : 1µL
- H2O : 5µL
We let our digestion 1h30 at 37°C.
B - PCB sensor system
Objective : obtaining Bba_K1155001, Bba_K1155002, BphR2
1 - Digestion of Bba_K11001, Bba_K1155002 and BphR2 in PSB1C3 by EcoRI/PstI and SacII to check the size of fragments
Abdou
Used quantities :
- EcoRI/PstI :
- DNA : 8µL
- Buffer Orange : 1.6µL
- EcoRI : 1µL
- PstI : 1µL
- H2O : 4.4µL
- SacII :
- DNA : 8µL
- Buffer Blue : 1.6µL
- SacII : 1µL
- H2O : 5.4µL
We let the digestion 1h30 at 37°C.
3 - PCR of digestion of Bba_K11001, Bba_K1155002 and BphR2 in PSB1C3
Anaïs, Sheng, Zhou
Used quantities :
.....
COLONIES PIQUEES DANS 20µL d'eau pour chaque colonie.
Used quantities :
- BphA1 or BphR1 or BphR2 : 2µL
- Mix : (it was divided in 2 tubes for each oligo combinaison with 23µL of mix in each tube)
- VF or Pfnr_Up : 6µL
- VR or Pfnr_Down or VR : 6µL
- dNTP : 6µL
- Buffer Dream Taq : 30µL
- Dream Taq : 6µL
- H2O : 246µL
....
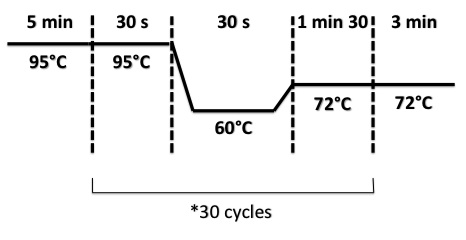
PCR Program :
- BphR1 :
- BphA1, BphR2 :
| Previous week | Back to calendar | next day |
 "
"